|
|
|
|
婴幼儿配方乳粉产品配方CFDA注册流程及时间
|
| |
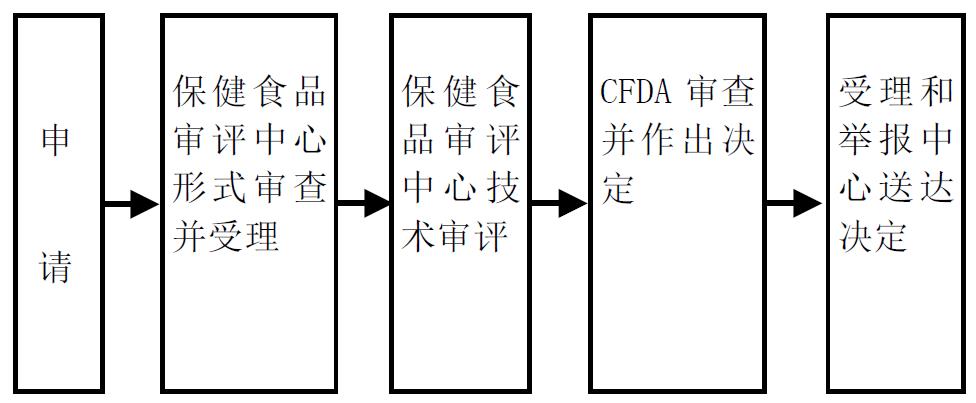
一、婴幼儿配方乳粉产品配方注册基本流程:
二、婴幼儿配方乳粉产品配方注册程序及时间
1.受理
申请人在国家食品药品监督管理总局网站登录婴幼儿配方乳粉产品配方注册申请系统,在线填报申请书和申请材料。电子申请完成后将纸质材料当面或邮寄至总局行政受理服务大厅,形式审查后作出是否受理的决定,并书面通知申请机构。
2.检验与核查
审评机构应当对申请材料以及产品配方声称与产品配方注册内容的一致性进行审查,并根据实际需要通知核查机构对申请人开展现场核查,组织检验机构开展抽样检验,组织专家对专业问题进行论证。
核查机构应当自接到审评机构通知之日起20个工作日内完成对申请人研发能力、生产能力、检验能力等情况的现场核查,出具现场核查报告。核查机构应当通知申请人所在地省级食品药品监督管理部门参与现场核查,省级食品药品监督管理部门应当派员参与。
审评机构应当委托具有法定资质的食品检验机构开展抽样检验。检验机构应当自接受委托之日起30个工作日内完成抽样检验工作,出具产品检验报告。
对境外生产企业现场核查、抽样检验的工作时限,根据实际情况确定。
3.技术审评
审评机构应当自收到受理材料之日起60个工作日内(现场核查、抽样检验、复审所需时间不计算在技术审评期限内)根据申请人申请材料、现场核查报告、产品检验报告开展审评,并作出审评结论。特殊情况下需要延长审评时间的,经审评机构负责人同意,可以延长30个工作日,延长决定应当书面告知申请人。
审评机构认为需要申请人补正材料的,应当一次性告知需要补正的全部内容。申请人应当在3个月内按照补正通知的要求一次补正材料。补正材料的时间不计算在审评时间内。逾期未补正的,按申请人不再提供补正材料处理。
审评机构作出不予注册审评结论的,应当向申请人发出拟不予注册的书面通知。申请人对通知有异议的,应当自收到通知之日起20个工作日内向审评机构提出书面复审申请并说明复审理由。复审的内容仅限于原申请事项及申请材料。
审评机构应当自受理复审申请之日起30个工作日内作出复审决定,并书面通知申请人。
4.行政审查与送达
国家食品药品监督管理总局自受理申请之日起20个工作日内根据审评结论作出准予注册或者不予注册的决定。现场核查、抽样检验、复审所需时间不计算在注册决定的期限内。审评时间不计算在注册决定的期限内。
受理机构应当自国家食品药品监督管理总局作出决定之日起10个工作日内向申请人发出婴幼儿配方乳粉产品配方注册证书或者不予注册决定。
对国家食品药品监督管理总局作出不予注册决定有异议的,申请人可以向国家食品药品监督管理总局提出书面行政复议申请或者向人民法院提起行政诉讼。
|
| |
|
|
|
|